-
Information
ブログリニューアル「CzeekV インデックス」
この度、本ブログのタイトル,デザイン等を大幅に刷新しました。
タイトルに合わせて「CzeekV」の活用、実践を中心としてお役に立てるようなコンテンツを
引き続き情報発信してまいります。
よろしくお願い致します。-
PickUp
-
◆安全性情報最前線におけるCzeekVの活用内容◆
2023年9月13日に薬事日報に記事が掲載されました。
上記リンクから該当ページの紹介ページをご覧ください。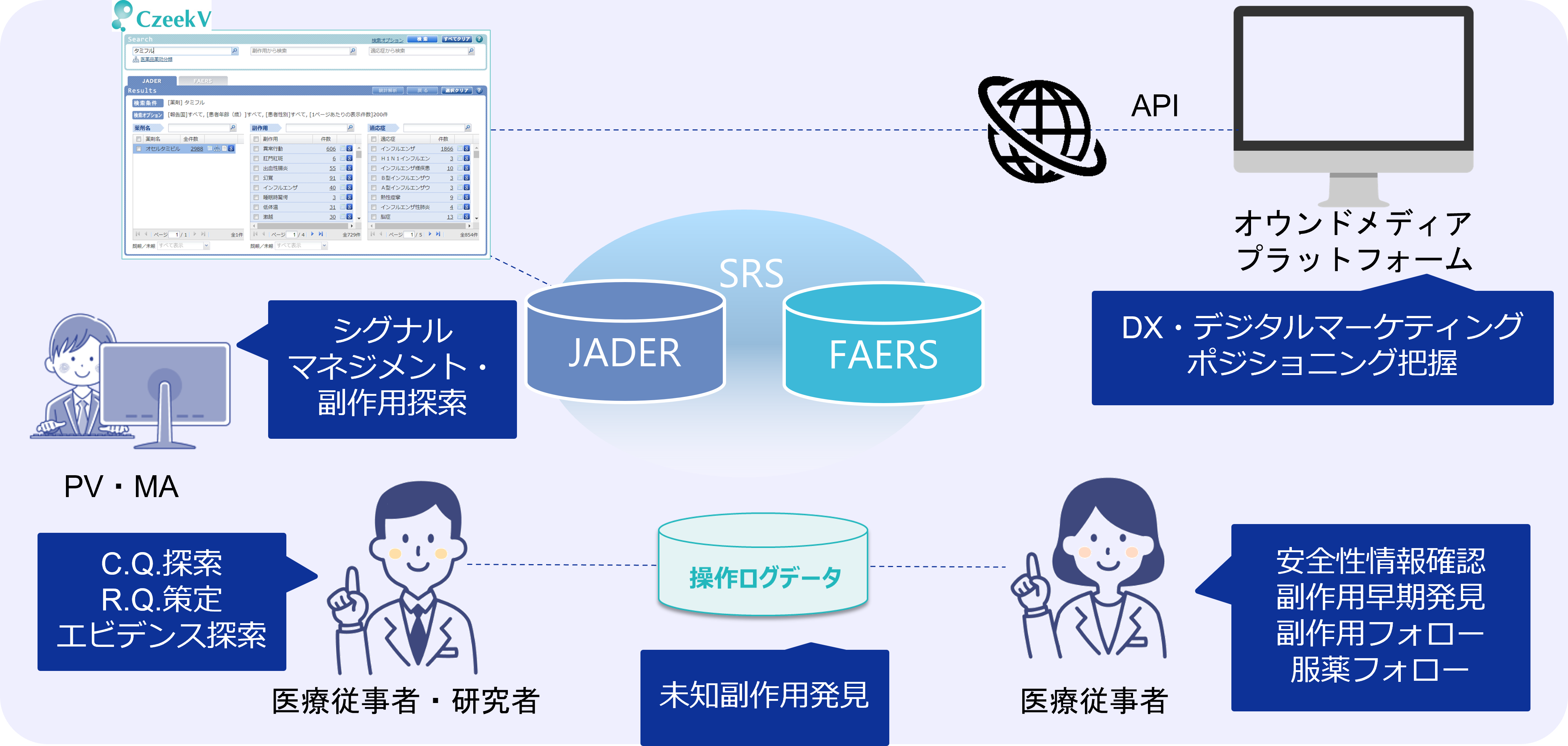
-
◆ブログ新コンテンツ「CzeekV ログデータグラフ」を公開しました。◆
CzeekVにおいて検索されている上位薬剤に関するログ情報をグラフ化しています。
(一部のログ情報を解析)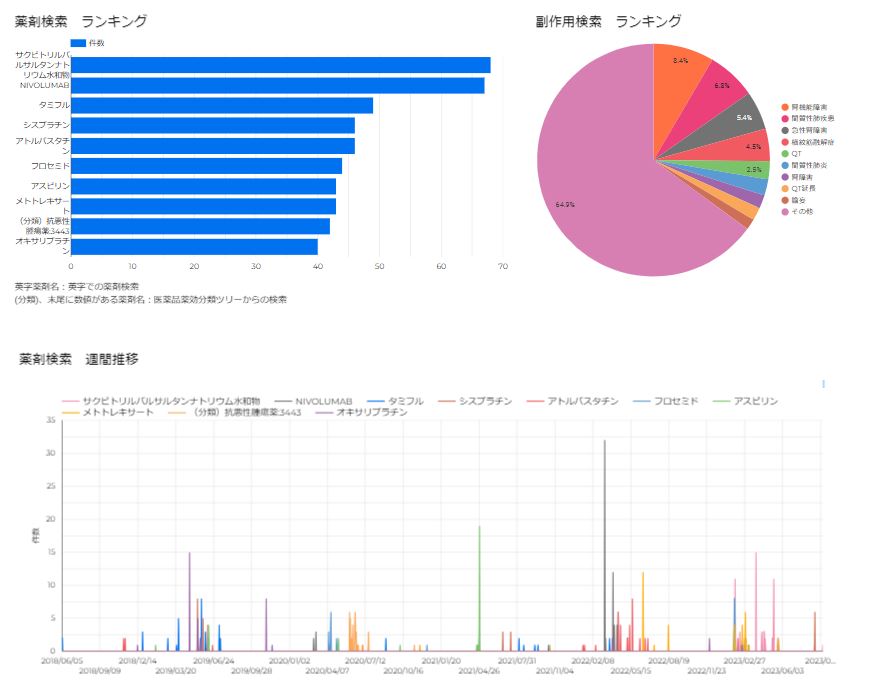
-
-
-
お問合わせ
検索
メルマガ登録
Facebook




